Параграф 15 Вопрос 6 ГДЗ Габриелян 9 класс (учебник 2020г) (Химия)
Решение #1

Рассмотрим вариант решения задания из учебника Габриелян 9 класс, Дрофа, Просвещение:
6 Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного.
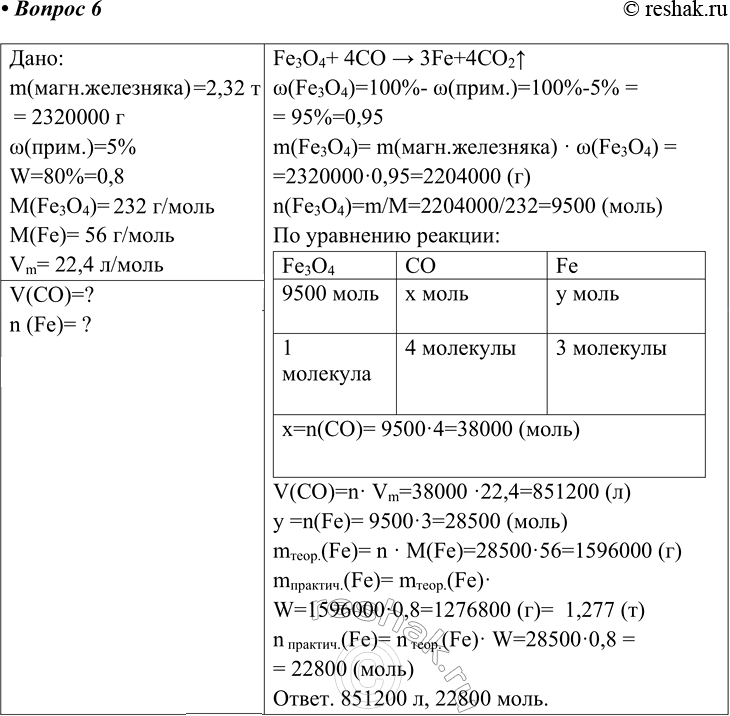
Дано:
m(магн.железняка)=2,32 т= 2320000 г
w(прим.)=5%
W=80%=0,8
M(Fe3O4)= 232 г/моль
M(Fe)= 56 г/моль
Vm= 22,4 л/моль
V(CO)=?
n (Fe)= ?
Fe3O4+ 4CO > 3Fe+4CO2^
w(Fe3O4)=100%- w(прим.)=100%-5% = 95%=0,95
m(Fe3O4)= m(магн.железняка) · w(Fe3O4) = 2320000·0,95=2204000 (г)
n(Fe3O4)=m/M=2204000/232=9500 (моль)
V(CO)=n· Vm=38000 ·22,4=851200 (л)
y =n(Fe)= 9500·3=28500 (моль)
mтеор.(Fe)= n · M(Fe)=28500·56=1596000 (г)
mпрактич.(Fe)= mтеор.(Fe)· W=1596000·0,8=1276800 (г)= 1,277 (т)
n практич.(Fe)= n теор.(Fe)· W=28500·0,8 = = 22800 (моль)
Ответ. 851200 л, 22800 моль.
Похожие решебники
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением









