Параграф 51 ГДЗ Кузнецова Титова 8 класс (Химия)




Рассмотрим вариант решения задания из учебника Кузнецова, Титова 8 класс, Вентана-Граф:
Задание 1. К каким из известных вам типов реакций относятся реакции нейтрализации, гидратации? Запишите уравнения этих реакций. Объясните, чем отличаются друг от друга реакции, обозначенные следующими схемами
Пример реакции нейтрализации:
LiOH + HCl = LiCl + H2O + Q
Эта реакция является экзотермической реакцией обмена и не является ОВР.
Пример реакции гидратации:
CaO + H2O = Ca(OH)2 + Q
Эта реакция является экзотермической реакцией соединения и не является ОВР.
Первая реакция относится к реакциям соединения и является ОВР.
Вторая реакция относится к реакциям соединения и не является ОВР.
Первая реакция относится к реакциям разложения и является ОВР.
Вторая реакция относится к реакциям разложения и не является ОВР.
Первая реакция относится к реакциям замещения и является ОВР.
Вторая реакция относится к реакциям обмена и не является ОВР.
Задание 2. К какому типу реакций можно отнести реакцию горения метана (метан является основной составляющей природного газа, используемого в быту)?
Реакция горения метана относится к экзотермическим реакциям и является ОВР.
1. В чём сущность химических реакций с позиций электронных представлений? В каком направлении обычно протекают реакции?
Сущность химической реакции состоит в разрушении химических связей в исходных веществах и в образовании новых связей в продуктах реакции. Это сопровождается изменением структуры, состава и свойств веществ, а также поглощением и выделением энергии.
Реакции обычно протекают в сторону образования более прочных связей.
2. Какие классификации химических реакций вам известны, какие признаки лежат в их основе? Приведите примеры реакций выделенных типов и их уравнения.
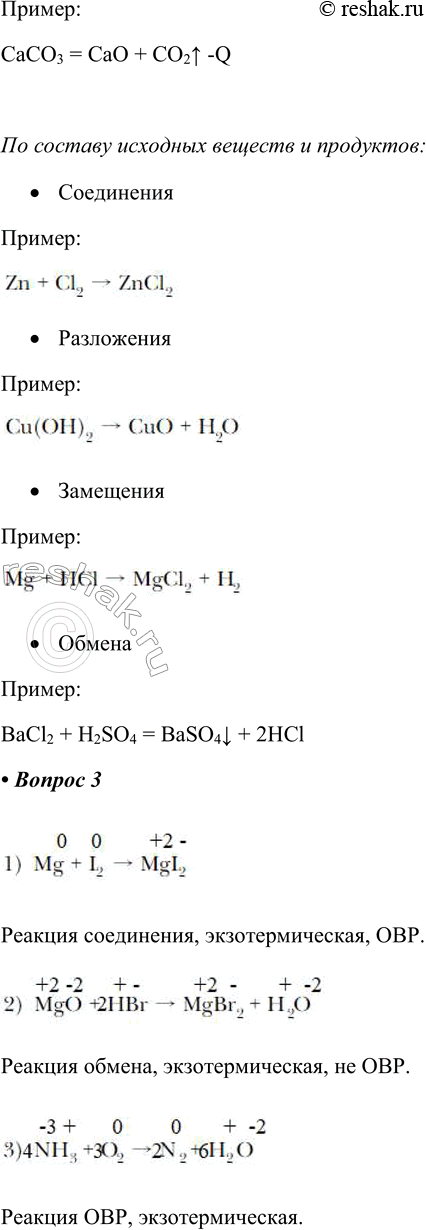
По признаку изменения степени окисления реакции бывают:
• ОВР (реакции идут с изменением степени окисления)
Пример
• Реакции, идущие без изменения степени окисления
Пример
FeCl3 + 3NaOH = Fe(OH)3v + 3NaCl
По тепловому эффекту
• Экзотермические (с выделением энергии)
Пример
• Эндотермические (с поглощением энергии)
Пример
CaCO3 = CaO + CO2^ -Q
По составу исходных веществ и продуктов:
• Соединения
Пример
• Разложения
Пример
• Замещения
Пример
• Обмена
Пример
BaCl2 + H2SO4 = BaSO4v + 2HCl
3. Определите тины реакций по их схемам и расставьте коэффициенты:
1) Mg + I2 — MgI2
2) MgO + HBr — MgBr2 + H2O
3) NH3 + O2 — N2 + H2O
4) FeCl3 + NaOH - Fe(OH)3 + NaCl
5) KI + CuCl2 — I2 + Cul + KCl
Реакция соединения, экзотермическая, ОВР.
Реакция обмена, экзотермическая, не ОВР.
Реакция ОВР, экзотермическая.
Реакция обмена, экзотермическая, не ОВР.
Реакция ОВР, экзотермическая.
4. Какие из перечисленных выше реакций относятся к окислительно-восстановительным? Объясните сущность и названия этих реакций в свете электронной теории.
Реакции ОВР
Молекулярный иод окисляет металлический магний с образованием иодида магния.
Некаталитическое окисление аммиака за счет передачи электронов от азота аммиака кислороду с образованием газа азота и воды.
Окисление иодида калия хлоридом меди (II) до молекулярного иода и иодида одновалентной меди.
5. К раствору хлорида натрия прилили раствор нитрата серебра. В результате их взаимодействия образовался осадок, масса которого составила 0,287 г. Вычислите количество вещества (моль) нитрата серебра, вступившего в реакцию.
NaCl + AgNO3 = AgClv + NaNO3
n(AgCl)=m/M=0,287/143,5= 0,002 (моль)
Ответ. 0,002 моль.
6. Определите количество вещества (моль) фосфорной кислоты, которое можно получить при нагревании 28,4 г оксида фосфора (V) с водой.
P2O5 + 3H2O = 2H3PO4
n(P2O5)=m/M=28,4/142= 0,2 (моль)
Ответ. 0,4 моль.
7. Составьте уравнения реакций между сероводородом, бромом и объясните функции веществ в этих реакциях с позиций электронной теории.
H2+S-2 + Br20 > H+Br- + S0v
Br20 +2e > 2 Br- - окислитель, восстановление
S-2 -2e > S0 - восстановитель, окисление
H2+S-2 + Br20 = 2H+Br- + S0v
Молекулярный бром окисляет сероводород до бромоводорода и серы.
Популярные решебники 8 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





