Часть ll Параграф 8 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Решение #1

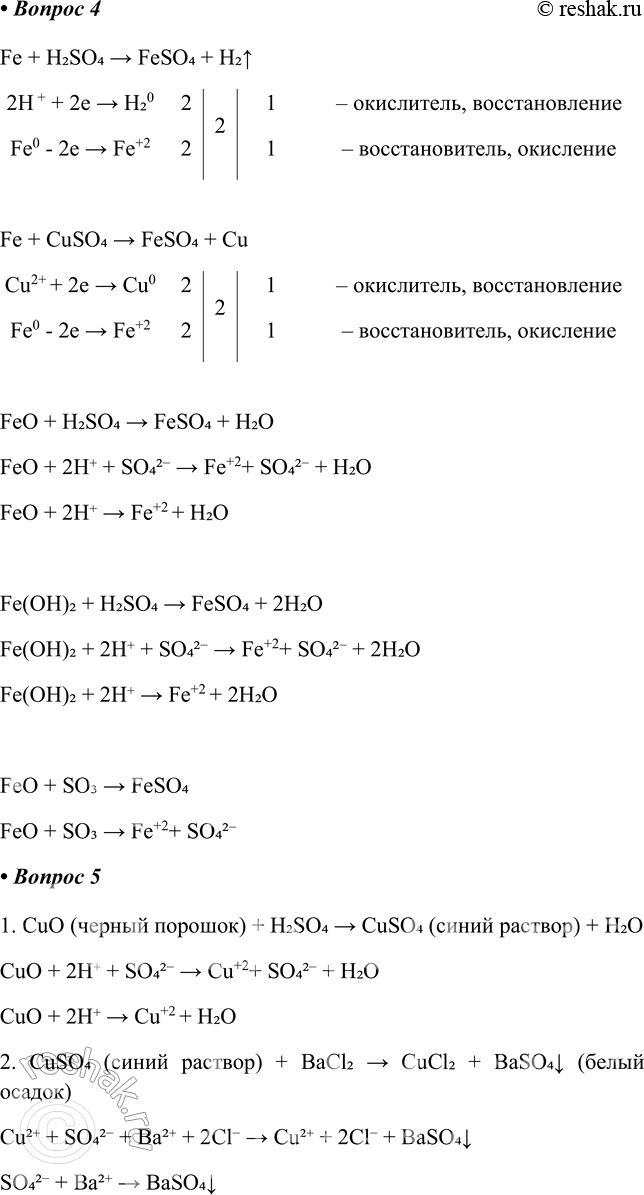

Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
Часть II
1. Приведите примеры молекулярных и ионных уравнений реакций солей с кислотами.
1) Для реагентов карбонатов:
2) Для продуктов сульфатов:
3) Для продуктов хлоридов:
1) Для реагентов карбонатов:
Na2CO3 + 2HCl > 2NaCl + H2O + CO2^
2Na+ + CO32- + 2H+ + 2Cl- > 2Na+ + 2Cl- + H2O + CO2^
CO32- + 2H+ > H2O + CO2^
2) Для продуктов сульфатов:
Ba(NO3)2 + H2SO4 > BaSO4v + 2HNO3
Ba2+ + SO42- + 2H+ + 2NO3- > BaSO4v + 2H+ + 2NO3-
Ba2+ + SO42- > BaSO4v
3) Для продуктов хлоридов:
AgNO3 + HCl > AgClv + HNO3
Ag+ + Cl- + H+ + NO3- > AgClv + H+ + NO3-
Ag+ + Cl- > AgClv
2. Приведите примеры молекулярных и ионных уравнений реакций солей с другими солями.
1) Для реагентов сульфатов:
2) Для продуктов сульфатов:
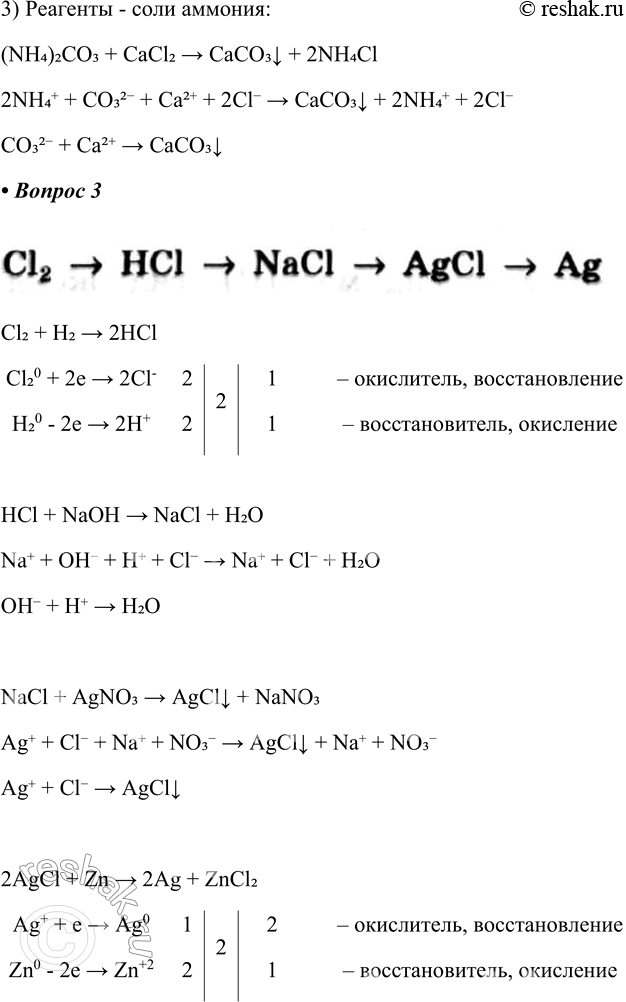
3) Для реагентов — солей аммония:
1) Реагенты - сульфаты:
Na2SO4 + BaCl2 > BaSO4v + 2NaCl
2Na+ + SO42- + Ba2+ + 2Cl- > BaSO4v + 2Na+ + 2Cl-
SO42- + Ba2+ > BaSO4v
2) Продукты - сульфаты:
CaCl2 + Na2SO4 > CaSO4v + 2NaCl
Ca2+ + 2Cl- + 2Na+ + SO42- > CaSO4v + 2Na+ + 2Cl-
Ca2+ + SO42- > CaSO4v
3) Реагенты - соли аммония:
(NH4)2CO3 + CaCl2 > CaCO3v + 2NH4Cl
2NH4+ + CO32- + Ca2+ + 2Cl- > CaCO3v + 2NH4+ + 2Cl-
CO32- + Ca2+ > CaCO3v
3. Составьте уравнения реакций, соответствующих следующим превращениям:
Сl2 - > НСl - > NaCl - > AgCl - > Ag
Расставьте коэффициенты в окислительно-восстановительных реакциях с помощью метода электронного баланса. Для реакций с участием электролитов напишите полные и сокращённые ионные уравнения.
4. Запишите молекулярные и ионные уравнения пяти возможных реакций получения сульфата железа(ІІ). Реакцию замещения рассмотрите как окислительно-восстановительную.
5. Даны вещества: оксид меди(ІІ), гидроксид натрия, хлорид бария, оксид магния, серная кислота, карбонат кальция. Используя воду и вещества из списка, получите в две стадии хлорид меди(ІІ). Укажите признаки протекания реакций и напишите их ионные уравнения.
1. CuO (черный порошок) + H2SO4 > CuSO4 (синий раствор) + H2O
CuO + 2H+ + SO42- > Cu+2+ SO42- + H2O
CuO + 2H+ > Cu+2 + H2O
2. CuSO4 (синий раствор) + BaCl2 > CuCl2 + BaSO4v (белый осадок)
Cu2+ + SO42- + Ba2+ + 2Cl- > Cu2+ + 2Cl- + BaSO4v
SO42- + Ba2+ > BaSO4v
6. С какими веществами из перечисленных будет взаимодействовать раствор хлорида бария?
а) сульфат меди(ІІ)
б) оксид меди(II)
в) гидроксид меди(II)
г) медь
д) цинк
е) гидроксид цинка
ж) карбонат натрия
з) нитрат натрия
Запишите уравнения реакций в молекулярной и ионной форме.
Раствор хлорида бария взаимодействует с сульфатом меди (II) и карбонатом натрия.
Ответ: А и Ж.
1. CuSO4 + BaCl2 > CuCl2 + BaSO4v
Cu2+ + SO42- + Ba2+ + 2Cl- > Cu2+ + 2Cl- + BaSO4v
SO42- + Ba2+ > BaSO4v
2. BaCl2 + Na2CO3 > BaCO3v + 2NaCl
2Na+ + CO32- + Ba2+ + 2Cl- > BaCO3 + 2Na+ + 2Cl-
Ba2+ + CO32- > BaCO3v
7. Цинковую пластинку опустили в 300 г раствора нитрата меди(ІІ), в результате чего её масса увеличилась на 1,11 г, а раствор обесцветился. Рассчитайте массовую долю соли в исходном растворе.
Похожие решебники
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением






